Руководитель Органа инспекции - Еремин Юрий Александрович
Заместитель руководителя Органа инспекции, технический директор - Багинская Яна Владимировна
И.о. заместителя руководителя Органа инспекции - Бирюкова Виктория Викторовна
ИНСПЕКЦИЯ ПРОИЗВОДИТЕЛЕЙ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ
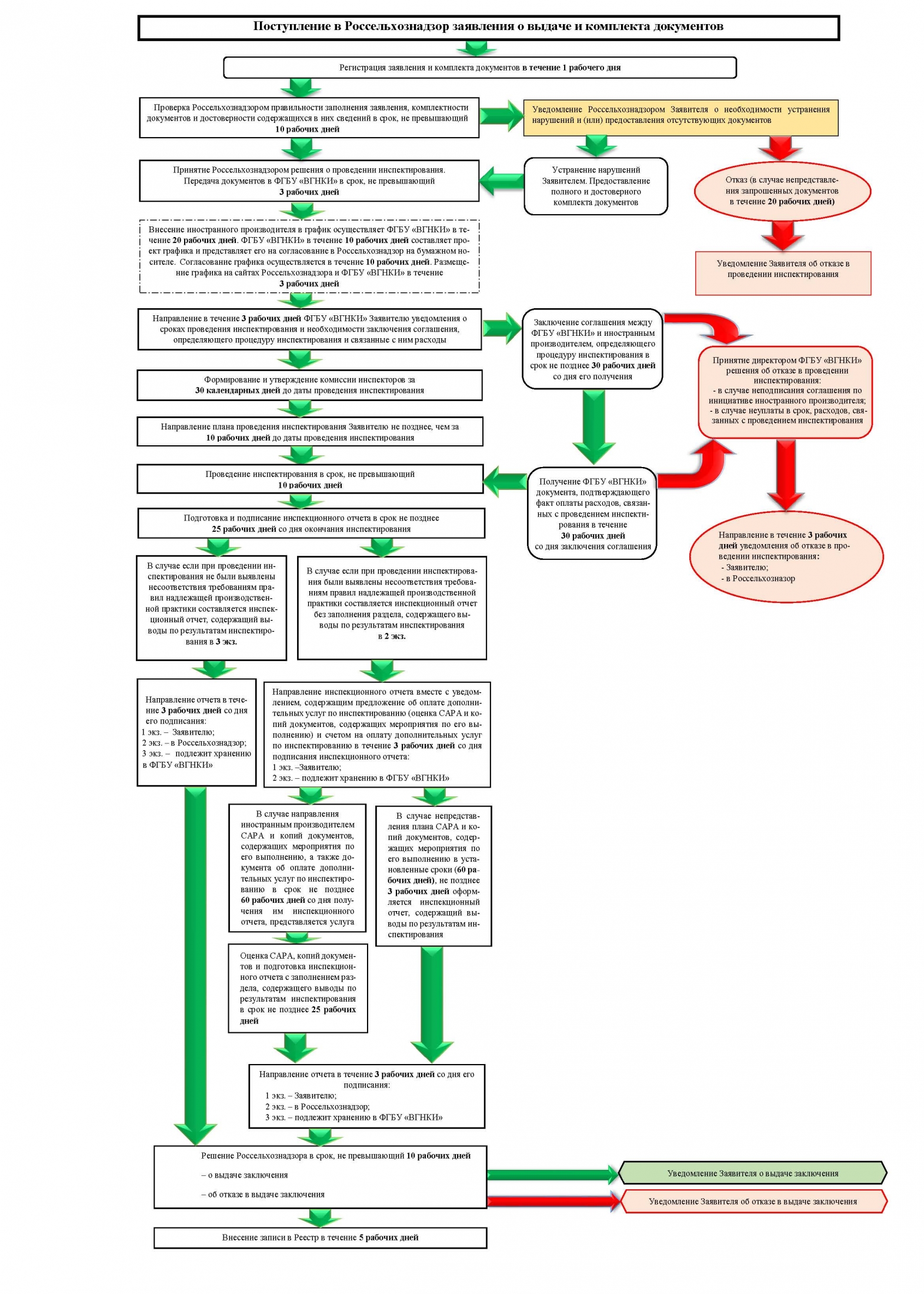
ФГБУ «ВГНКИ» на основании Постановления Правительства Российской Федерации от 03.12.2015 № 1314 «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» (далее - постановление №1314) и приказа Руководителя Федеральной службы по ветеринарному и фитосанитарному надзору от 29.02.2016 № 97 является уполномоченным учреждением на проведение инспектирования производителей лекарственных средств для ветеринарного применения на соответствие требованиям надлежащей производственной практики, производство которых осуществляется за пределами Российской Федерации (далее – иностранный производитель).
В соответствие с п.19 постановления №1314 расходы, связанные с проведением инспектирования иностранного производителя, осуществляются за счет средств иностранного производителя. Размер платы за оказание услуги по инспектированию определяется в соответствии с приказом Россельхознадзора от 07.10.2020 № 1078 «Об утверждении методики расчета предельного размера платы за оказание услуги по инспектированию производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям правил надлежащей производственной практики в целях выдачи заключений о соответствии производителя лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики и предельного размера платы за оказание указанной услуги» (далее приказ № 1078). Полный текст приказа № 1078 размещен в разделе «нормативно-правовая документация».
Инспектирование иностранных производителей осуществляется в сроки согласно графику проведения инспектирования.
Реестр заключений о соответствии производителя требованиям правил надлежащей производственной практики и Реестр фармацевтических инспекторов ветеринарного фармацевтического инспектората Российской Федерации размещён на официальном сайте Федеральной службы по ветеринарному и фитосанитарному надзору (Россельхознадзор).
В соответствии с п. 27 постановления N 1314, производитель или его уполномоченный представитель в срок не позднее 60 рабочих дней со дня получения им инспекционного отчета вправе представить в уполномоченное учреждение письмо с приложением плана корректирующих и предупреждающих действий и копий документов, оформленных в установленном порядке, содержащих мероприятия по его выполнению.
Материалы могут быть переданы в электронном виде на официальную почту vgnki@fsvps.gov.ru с последующим обязательным посылом по почте.